Цель: обобщить и углубить знания учащихся о свойствах кислот в свете теории
электролитической диссоциации, продолжить совершенствование умения
учащихся составлять ионные уравнения реакций.
Оборудование: растворы азотной кислоты, силиката калия, серной кислоты,
карбоната калия, хлорида бария, соляной кислоты, гидроксида
натрия, фенолфталеина, сульфата меди (II), сульфата железа (II);
гранулы цинка, свинца, алюминия меди.
Ход урока
I. Проверка домашнего задания.
Самостоятельная работа
Напишите в полной и сокращенной ионной форме уравнения реакций,
представленных следующими схемами:
Вариант I
1) НNO 3 + Ba(OH) 2 ® Ba(NO 3 ) 2 + H 2 O
2) AgNO 3 + K 3 PO 4 ® Ag 3 PO 4 + KNO 3
3) BaCO 3 + HCl ® BaCl 2 + H 2 O + CO 2
4) Na 2 CO 3 + KCl ® K 2 CO 3 + NaCl
Вариант II
1) NaOH + FeCl 3 ® Fe(OH) 3 + …?
2) С aCO 3 + HNO 3 ® Ca(NO 3 ) 2 + …?
3) Mg(NO 3 ) 2 + NaCl ® MgCl 2 + …?
4) Ca(OH) 2 + HCl ® CaCl 2 + …?
Вариант III
1) С uSO 4 + KOH ®
2) K 2 CO 3 + Na 2 SO 4 ®
3) MgCO 3 + H 2 SO 4 ®
4) H 3 PO 4 + NaOH ®
II. Изучение нового материала.
а) Актуализация знаний учащихся.
- Какие вещества относятся к классу кислот?
- Дайте определение кислотам.
- Какие виды химической связи в молекулах кислот?
- что вам известно о химических свойствах кислот?
- Приведите схему классификации кислот. Подтвердите схему примерами.
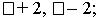
б) Изучение нового материала (запись определений).
в) Выполнение лабораторных опытов («Рабочая тетрадь», стр.132 –
139, упр.2, 5, 7, 12):
Опыт №1. Взаимодействие кислот с щелочами.
Опыт №2. Взаимодействие кислот с нерастворимыми основаниями.
Опыт №3. Взаимодействие кислот с солями.
Опыт №4. Взаимодействие кислот с металлами.
IV. Подведение итогов урока.
V. Домашнее задание: §38; стр.159 – 160, упр.4, 3, 2, 1.














