Цель: сформировать у учащихся представление об ионах (положительных и
отрицательных), ионной связи.
Ход урока
I. Проверка домашнего задания.
Опрос у доски:
– Какие изменения происходят с атомами элементов в подгруппе сверху вниз?
– Какие изменения происходят с атомами элементов в периоде слева
направо?
II. Актуализация знаний учащихся.
а) Химическая разминка.
Учитель показывает карточки со схемами строения атомов:
|
? |
? ? |
2 8 3 |
? ? |
|
2 ? 7 |
2 ? ? |
2 ? 18 ? |
2 8 ? |
Учащиеся отвечают на вопросы.
б) Задание. Составьте схему строения атомов водорода, натрия, фтора.
Вопросы:
– Сколько электронов на последнем энергетическом уровне имеют атомы
натрия и фтора?
– Сколько электронов не хватает атомам натрия до завершения
энергетического уровня?
– Сколько электронов не хватает атомам фтора до завершения
энергетического уровня?
– Как вы думаете, какой из этих элементов (натрий или фтор) может легче
отдать электроны?
– Какой из этих элементов легче примет электроны?
III. Изучение нового материала.
– А теперь, ребята, я расскажу вам сказку про фтор и натрий.
Итак, в большом семиэтажном доме на втором этаже жил-был фтор. И была у фтора, как у всех неблагородных элементов, своя заветная мечта. Очень завидовал он неону – благородному газу, у которого был завершен второй энергетический уровень. Всего одного электрона не хватало фтору для полного счастья.
Вот и решил наш герой, во что бы то ни стало заполучить этот недостающий электрон.
И вот однажды встретил фтор, натрий, у которого на последнем энергетическом уровне был один электрон. Он попросил отдать или подарить ему его.
Но натрий не так-то легко было уговорить.
– Что ты, я тоже мечтаю быть благородным! Мне нужно найти 7 электронов, и я стану похожим на аргон! – сказал натрий.
Тут фтор решил прибегнуть к хитрости: «Давай объединим свои электроны, и, когда они будут общими, я стану похожим на неон, а ты на аргон».
Так они и порешили.
+11 Na ) ) ) + +
2 8 1 2 7
|____ 8e _____|
Вот так образовалась молекула фторида натрия.
Обрадовался натрий, загордился. Но недолго ему пришлось радоваться. так как хитрый и жадный фтор притянул к себе общую электронную пару и остался натрий совсем без своего любимого электрона.
Очень не понравилось ему это, решил он уйти от фтора. Но не смог, так как без электрона он превратился в ион:
+11 Na ) ) ) + +
2 8 1 2 7 2 8 2 8 8
|_____1e_____
Назвали люди натрий восстановителем, фтор – окислителем, реакцию – окислительно-восстановительной, а такую связь – ионной.
– Запишем определения:
Химическая связь, возникающая между ионами, называется ионной.
Ионная связь образуется между ионами типичных металлов и ионами типичных неметаллов.
IV. Закрепление (фронтальная работа)
Na0 – 1е ® Na+
F0 + 1e ® F–
2Na0 + 2F0 ® 2NaF.
Цель: закрепить умение схематически изображать процесс образования ионной
связи.
- Изобразите схемы образования ионной связи между:
атомами лития и хлора (вариант 1) ;
атомами калия и брома (вариант 2) ;
атомами натрия и йода (вариант 3) .
- На основании составленных схем образования ионной связи ответьте на вопрос:
– При соединении атомов каких элементов может образоваться ионная
связь?
- Выполнение упражнений («Рабочая тетрадь»): стр.25, упр. 1, 3, 4, 5.
V. Домашнее задание: §9 (до конца), стр.38, упр.2.


 )
) ) )
) ) ) ) )
) ) )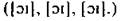 ) )
) ) ) ) )
) ) ) ) ) )
) ) ) ) ) ) )
) ) ) ) ) ) )
) ) )










